Введите слово или словосочетание на любом языке 👆
Язык:
Перевод и анализ слов искусственным интеллектом ChatGPT
На этой странице Вы можете получить подробный анализ слова или словосочетания, произведенный с помощью лучшей на сегодняшний день технологии искусственного интеллекта:
- как употребляется слово
- частота употребления
- используется оно чаще в устной или письменной речи
- варианты перевода слова
- примеры употребления (несколько фраз с переводом)
- этимология
Что (кто) такое бор - определение
СТРАНИЦА ЗНАЧЕНИЙ В ПРОЕКТЕ ВИКИМЕДИА
Бор (город); Бор (Ленинградская область); БОР; Бор (село); Бор (муниципалитет); Бор (Псковская область); Бор (Лужский район); Бор (Ярославская область)
Найдено результатов: 205
Бор
Бор (borum, стар. назв. boracium и boron, последнее принято еще итеперь у англичан; хим. форм. В; атомный вес 11) - не металлическийэлемент, в свободном состоянии известный в двух аллотропическихвидоизменениях: аморфном и кристаллическом. В аморфном виде бор былполучен в 1808 г. Гэй-Люссаком и Тенаром и ближе изучен в 1857 г.Вёлером и Сен-Клер-Девиллем, давшими способы приготовлениякристаллического бора. В природе это тело никогда не встречается всвободном состоянии, но лишь в соединении с кислородом, в виде борнойкислоты и некоторых ее солей. По свойствам своим бор близко стоит куглероду: обыкновенному углю соответствует аморфный бор, представляющийпорошок бурого цвета, без вкуса и запаха; кристаллический (или алмазный)бор, по блеску и твердости, весьма сходен с алмазом. Для получения аморфного бора (по Вёлеру и Девиллю) в раскаленныйчугунный тигель всыпают смесь 100 ч. борного ангидрида с 60 ч.металлического натрия и покрывают все слоем прокаленной поваренной соли(от 40 до 50 ч.); наступает бурная реакция, причем часть борногоангидрида отдает свой кислород натрию; бор выделяется в свободномсостоянии, и вместе с тем образуется бура; сплав перемешивают железнымпрутом, выливают в воду, подкисленную соляной кислотой, и собираютостающийся нерастворенным бор на фильтре; в виде аморфного порошка онлегко проходить через поры бумаги, висит в воде и сообщает ей буруюокраску, так что его считают в воде растворимым; сушить порошок следуетна пористых фарфоровых пластинках, при обыкновенной температуре, так какпри более сильном подогревании бор легко загорается. Берцелиусприготовлял его, нагревая борофтористый калий KBF4 с металлическимкалием. Магний, а также уголь и фосфор восстановляют бор из его окиси.Аморфный бор легко реагирует со многими веществами: загораясь, принакаливании, на воздухе, он соединяется не только с кислородом, но и сазотом; кислоты, особенно при нагревании, окисляют его в борную кислоту;щелочи действуют подобным же образом, с выделением водорода; при высокойтемпературе металлы, сера, хлор, бром, прямо соединяются с бором. Для получения кристаллического видоизменения, плотно набиваютнебольшой тигель аморфным бором, просверливают в массе небольшоеотверстие, достаточное для того, чтобы вставить палочку металлическогоалюминия, и помещают плотно закрытый тигель в другой, больших размеров,а промежуточное пространство засыпают углем; наружный тигель закрываюткрышкой, замазывают и накаливают 11/2 - 2 часа при температуре около1500°. По охлаждении растворяют алюминий в едком натре и обрабатываютостаток соляной кислотой. Полученный таким образом бор представляетпросвечивающие красновато-желтые квадратные кристаллы, уд. веса 2, 68,по свойствам напоминающие алмаз; они обладают большой способностьюлучепреломления и твердостью: чертят, подобно алмазу, корунд и сапфир.Известно несколько разновидностей кристаллического бора, получающихсяразличными способами, но все они не представляют химически чистоговещества, а содержат углерод и алюминий, другие же только углерод. Поисследованиям Гампе здесь имеются определенные химические соединения,состава B48 Аl3 C2 и В12 Аl. Кристаллический бор несравненно болеепостоянен относительно химических деятелей, чем аморфный: он весьматрудно окисляется при накаливании в чистом кислороде; точно также онхорошо сопротивляется действию кислот, за исключением царской водки.Весьма интересны определения теплоемкости кристаллического бора (Вебер):оказывается, что она быстро возрастает с повышением температуры, подобнотому, как это наблюдается и для угля. Такого рода факт весьма важен дляубеждения в общности закона Дюлонга и Пти, так как определения,сделанные при низких, сравнительно, температурах, дают для атомнойтеплоемкости числа. которые значительно менее требуемых законом; напр.,при - 40° теплоемкость равна 0,1915, а при +233° она уже доходит до0,3663. В своих соединениях бор функционирует, как трехатомный элемент, начто указывает и место его в периодической системе: он помещается втретьей группе вместе с алюминием и в одном ряду с углеродом (В=11;С=12). Непосредственным соседством с этим последним элементомобъясняется до известной степени существование аллотропическихвидоизменений бора. Таким образом, общая формула борных соединений будетВХ3 (где Х==Сl, Вr, ОН и т.п. ). Из них, как уже упомянуто, наиболееважными, и между прочим единственными источниками для получения всехдругих соединений, являются борная кислота и ее соли.
бор
муж., хим. горючее вещество, добываемое из буры и служащее основанием борной кислоте.
II. БОР муж. (брать) браньё, взятие, отпуск и прием; бору нет, говорят купцы, разбору, спросу на товар.
| ·*костр., ·торг. базар, рынок, торжок; новинный бор, холщевый базар.
| ·стар. сбор, побор, подать, денежная повинность. Бором, борком брать, руками, рвать. Бор ягод, сбор. Бор рыбы, клев. Брать товар на бор, в бор, в долг, не за наличные.
| Красный или хвойный лес; строевой сосновый или еловый лес по сухой почве, по возвышенности; преснина, чистый мендовый сосняк, по супеси; хвойник с ягодными кустами и грибами. От искры сыр бор загорался. Баба по бору ходила, трои лапти износила, долго. Чужая душа - дремучий бор. Баженый не с борка, а с топорка. Всякая сосна своему бору шумит (своему лесу весть подает). Сыр-бор загорелся, беда, шум из пустого.
| ·*архан., ·*новг. могильник, кладбище, божья нивка, потому что там для кладбищ выбирается суходол, либо пригорье. На борке, ·*новг.-валд. на кладбище.
| ·*ниж. бора, складка в одежде, морщина в лице.
| Растение Panicum miliaceum, Milium effusum, черное, птичье просо, просовик, просовка, род проса в черных шишках (·*симб. ·*сам.)
| Дивий бор, растение Alopecurus pratensis, глашник, луговой пырей, лисий хвост, однородное с аржанцом. Боровой, к бору, лесу относящийся. Боровое место, хрящеватое, сухое, под хвойным лесом, можжевелом и вереском. Боровой кулик, березовик, слука, вальдшнеп. Боровая каша, из боровой крупы, из пшена бора. Боровой изгон, мохнатик, волосатик, растение Adonis vernalis. Боровной лес, ·*сев. сосновый, строевой и мачтовый, по суходолу. Бористое место, боровое, обильное борами. Бористый кафтан, с борами (см. бора
). Боровина жен. боровая, хвойная, нехлебная почва. Боровинка ·умалит. порода мелких, но хороших яблок. Боровик муж. съедомый гриб Boletus bovinus (mutabilis?)
). Боровина жен. боровая, хвойная, нехлебная почва. Боровинка ·умалит. порода мелких, но хороших яблок. Боровик муж. съедомый гриб Boletus bovinus (mutabilis?)
| ·*арх.-мез. метла, голик, веник, потому что веники вяжут в березняке, в бору, по суходолу, не по тундре.
| В картежной игре, подбор красной масти, боровики, а черной, вороново крыло.
| Тетерев, особенно косач, но гораздо рослее простого (полевого), вероятно помесь тетерева и глухаря.
| ·*калуж. кабачная ендова.
| Боровики мн. дикие, боровые пчелы;
| растение Chimaphila umbellata, становник, изгон боровой, изгон раменный. Боровика жен., ·*ряз. куст и ягода брусена, брусника. Боровник муж. растение Digitaria, мохарь.
| Растение Blitum, боровик, жминда, жмонда, бросовая трава; Blitum virgatum, сорочьи ягоды. Боровая няша, боровница. ·*сев. лекарственное в народе растение, по берегам боровых озер и котловин. Бореть ·*пск. о залежи: порастать хвойником, зарослями.
БОР
аномально высокая волна, движущаяся вверх по реке от эстуария, где конфигурация побережья обусловила чрезвычайно большую амплитуду приливов. Поступающие приливные воды нагнетаются в суженное устье реки, и если они не выходят за пределы русла, то образуют волну, которая движется вверх по течению со значительной скоростью и силой, представляя собой угрозу для судоходства. Гребень этой волны и есть бор, иногда называемый маскаре (на атлантическом побережье Франции) и поророка (на Амазонке). В Северной Америке хорошо известен бор, достигающий высоты 1,2 м, который образуется во время приливов в заливе Фанди на востоке Канады. Знаменит также бор в одном из рукавов залива Кука южнее Анкориджа (Аляска). Самый большой в мире бор, высотой до 4,5 м, наблюдается на р.Фучуньцзян близ Ханчжоу (Китай).
бор
БОР, бора; ·муж. (от ·нем. Bohrer - бурав) (мед.). Стальное сверло с мелкими острыми нарезками, употр. в зубоврачебном деле.
• Бормашина (спец.) - аппарат для высверливания частей зуба.
II. БОР, бора, о боре, в бору, мн. боры, боров, ·муж. Большой, густой хвойный лес. Сосновый бор.
• С бору да с сосенки или с бору по сосенке (погов.) - Откуда попало, без разбора. Откуда сыр бор загорелся (·т.е. сырой бор; погов.) - из-за чего затеялось дело, отчего начался переполох.
III. БОР, бора, мн. нет, ·муж. (·иностр.) (·хим. ). Одно из простых химических веществ, входящих в состав многих минералов.
БОР
I
а, м.
Стальное сверло, применяемое в зубоврачебной практике.
II
а, мн. нет, м.
Химический элемент - серовато-черное кристаллическое вещество. Борный - относящийся к соеди-нениям бора (напр., борная кислота). | Раньше других соединений бора стала известна бура - как од-но из соединений бора; отсюда название.
Бор
I
(Bohr)

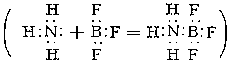

Нильс Хенрик Давид (7.10.1885, Копенгаген, - 18.11.1962, там же), датский физик. Создал первую квантовую теорию атома, а затем участвовал в разработке основ квантовой механики (См. Квантовая механика). Внёс также значительный вклад в развитие теории атомного ядра и ядерных реакций, процессов взаимодействия элементарных частиц со средой. В 1908 Б. окончил университет в Копенгагене. Здесь он выполнил свои первые работы по исследованию колебаний струй жидкости (1907-10) и классической электронной теории металлов (1911). В 1911-12 работал в Кембридже у Дж. Дж. Томсона и в Манчестере у Э. Резерфорда. В 1914-16 читал курс математической физики в Манчестере. В 1916 получил кафедру теоретической физики в Копенгагене. С 1920 и до конца жизни руководил созданным им институтом теоретической физики в Копенгагене, который теперь носит его имя. В 1943, когда стало известно о готовящейся гитлеровцами, оккупировавшими Данию, расправе над Б., он был вывезен на лодке организацией Сопротивления в Швецию, а оттуда на английском военном самолёте - в США. Здесь Б. участвовал в работах по созданию атомной бомбы. После войны вернулся в Данию. Активно участвовал в борьбе против атомной угрозы.
Работая в Манчестере, Б. воспринял сформулированное Резерфордом в 1911 представление о планетарном строении атома. Однако уже в то время было ясно, что такое строение (ядро и вращающиеся вокруг него по орбитам электроны) противоречит классической электродинамике и механике. По законам классической электродинамики электрон в атоме должен был бы непрерывно излучать электромагнитные волны, потерять свою энергию за ничтожно малую долю секунды и упасть на ядро. Следовательно, согласно классической физике, устойчивые движения электронов в атоме невозможны и атом как динамическая система существовать не может. Исходя из идеи квантования энергии, выдвинутой ранее М. Планком в теории излучения (см. Излучение), Б. разработал и в 1913 опубликовал теорию атома, в которой показал, что планетарная структура атома и свойства его спектра излучения могут быть объяснены, если считать, что движение электрона подчинено некоторым дополнительным ограничениям - т. н. постулатам Б. Согласно этим постулатам, для электрона существуют избранные, или "разрешенные", орбиты, двигаясь по которым, он, вопреки законам классической электродинамики, не излучает энергии, но может скачком перейти на более близкую к ядру "дозволенную" орбиту и при этом испустить квант (порцию) электромагнитной энергии, пропорциональный частоте электромагнитной волны. Построенная на этих постулатах и развитая затем самим Б. и другими физиками теория атома впервые объяснила его особую устойчивость, сохранение атомом при сравнительно слабых столкновениях своей структуры и характера спектра.
В 1923 Б. сформулировал количественно т. н. принцип соответствия (см. Соответствия принцип), указывающий, когда именно существенны эти квантовые ограничения, а когда достаточна классическая физика. В том же году Б. впервые удалось дать на основе своей модели атома объяснение периодической системы элементов Менделеева. Однако теория Б. в целом содержала внутреннее противоречие в своей основе, поскольку она механически объединяла классические понятия и законы с квантовыми условиями, и не могла считаться удовлетворительной. Кроме того, она была неполной, недостаточно универсальной, т.к. не могла быть использована для количественного объяснения всего многообразия явлений атомного мира. Такой теорией явилась квантовая механика - теория движения микрочастиц, созданная в 1924-26 Л. де Бройлем (См. Бройль), В. Гейзенбергом и Э. Шрёдингером.
Однако основные идеи квантовой механики, несмотря на её формальные успехи, в первые годы оставались во многом неясными. Для полного понимания физических основ квантовой механики, её связи с классической физикой был необходим дальнейший глубокий анализ соотношения классического (макроскопического) и квантового (микроскопического - на атомном и субатомном уровнях) материальных объектов, процесса измерения характеристик микрообъекта и вообще физического содержания используемых в теории понятий. Этот анализ потребовал напряжённой работы, в которой ведущую роль сыграл Б. Его институт стал центром такого рода исследований. Главная идея Б. заключалась в том, что заимствованные из классической физики динамические характеристики микрочастицы (например, электрона) - её координата, импульс (количество движения), энергия и др. - вовсе не присущи частице самой по себе. Смысл и определённое значение той или иной характеристики электрона, например его импульса, раскрываются во взаимосвязи с классическими объектами, для которых эти величины имеют определённый смысл и все одновременно могут иметь определённое значение (такой классический объект условно называется измерительным прибором). Эта идея имеет не только принципиальное физическое, но и философское значение. В результате была создана последовательная, чрезвычайно общая теория, внутренне непротиворечиво объясняющая все известные процессы в микромире для нерелятивистской области (т. е. пока скорости частиц малы по сравнению со скоростью света) и в предельном случае автоматически ведущая к классическим законам и понятиям, когда объект становится макроскопическим. Были также заложены основы релятивистской теории.
В 1927 Б. дал формулировку важнейшего принципа - принципа дополнительности, утверждающего невозможность при наблюдении микромира совмещения приборов двух принципиально различных классов, соответственно тому, что в микромире нет таких состояний, в которых объект имел бы одновременно точные динамические характеристики, принадлежащие двум определённым классам, взаимно исключающим друг друга. Это в свою очередь обусловлено тем, что не существует таких наборов классических объектов (измерительных приборов), в связи с которыми микрообъект обладал бы одновременно точными значениями всех динамических величин (см. Дополнительности принцип).
В 1936 Б. сформулировал фундаментальное для ядерной физики представление о характере протекания ядерных реакций (модель составного ядра). В 1939 совместно с Дж. А. Уилером он развил теорию деления ядер - процесса, в котором происходит освобождение огромных количеств ядерной энергии. В 40-50-х гг. Б. занимался в основном проблемой взаимодействия элементарных частиц со средой.
Б. создал большую школу физиков и многое сделал для развития сотрудничества между физиками всего мира. Институт Б. стал одним из важнейших мировых научных центров. Выросшие в этом институте физики работают почти во всех странах мира. В своём институте Б. принимал также советских учёных, многие из которых работали там подолгу. Б. неоднократно приезжал в СССР и в 1929 был избран иностранным членом АН СССР. Он являлся членом Датского королевского научного общества (с 1917), а также членом многих академий и научных обществ мира. Лауреат Нобелевской премии (1922).
Соч.: Das Quantenpostulat und die neuere Entwicklung der Atomistik, "Naturwissenschaften", 1928, H. 15, S. 245; Neutron capture and nuclear constitution, "Nature", 1936, v. 137, № 3461, p. 344; The mechanism of nuclear fission, "Physical Review", 1939, v. 56, p. 426 (совм. с J. A. Wheeler); в рус. пер. - Три статьи о спектрах и строении атомов, М., 1923; Прохождение атомных частиц через вещество, М., 1950; Атомная физика и человеческое познание, М., 1962.
Лит.: Нильс Бор и развитие физики, пер. с англ., М., 1960 (библ.); Нильс Бор. Жизнь и творчество, пер. с дат., М., 1967; Мур P., Нильс Бор - человек и ученый, пер. с англ., М., 1969.
Е. Л. Фейнберг.

Н. Бор.
II
(Bohr)
Оге (р. 19.6.1922, Копенгаген), датский физик, член Датской АН (1955). Сын Н. Бора. Окончил университет в Копенгагене. С 1946 в Институте теоретической физики (в 1963-72 директор); работает также в Северном институте теоретической ядерной физики ("Нордита"). Профессор Копенгагенского университета (с 1956). Основные труды по ядерной физике. Создал коллективную модель ядра (совместно с Б. Моттельсоном). Нобелевская премия (1975). Член Норвежской АН (1962), Шведской АН (1965), Американской академии искусств и наук (1965).
III
(Bohr)
Харальд (22.4.1887, Копенгаген, - 22.1.1951, там же), датский математик. Брат физика Н. Бора. С 1915 профессор Высшей технической школы и с 1930 - университета в Копенгагене, работал в области теории функций и теории чисел. В связи с исследованиями дзета-функции развил теорию почти периодических функций (См. Почти периодическая функция) (1923). Эта теория, превратившаяся в самостоятельную математическую дисциплину, имеет многочисленные приложения в математическом анализе, небесной механике и физике.
Соч. в рус. пер.: Почти периодические функции, М. - Л., 1934.
Лит.: Titchmarsh Е. С., Harald Bohr, "Journal of London Mathematical Society", 1953, t. 28, № 109, p. 1.
IV
(лат. Borum)
В, химический элемент III группы периодической системы Менделеева, атомный номер 5, атомная масса 10,811; кристаллы серовато-чёрного цвета (очень чистый Б. бесцветен). Природный Б. состоит из двух стабильных изотопов: 10B (19\%) и 11B (81\%). Ранее других известное соединение Б. - Бура - упоминается в сочинениях алхимиков под арабским названием "бурак" и латинским Borax, откуда и произошло наименование "бор". Свободный Б. (нечистый) впервые получили французские химики Ж. Гей-Люссак и Л. Тенар в 1808 нагреванием борного ангидрида B2O3 с металлическим калием. Общее содержание Б. в земной коре 3•10-4\% по массе. В природе Б. в свободном состоянии не обнаружен. Многие соединения Б. широко распространены, особенно в небольших концентрациях. В виде боросиликатов, боратов, бороалюмосиликатов, а также как изоморфная примесь в других минералах Б. входит в состав многих изверженных и осадочных пород. Соединения Б. найдены в нефтяных водах, морской воде, соляных озёрах, горячих источниках, в вулканических и сопочных грязях, во многих почвах. О главных природных соединениях Б., служащих для его промышленного получения, см. в ст. Бораты природные.
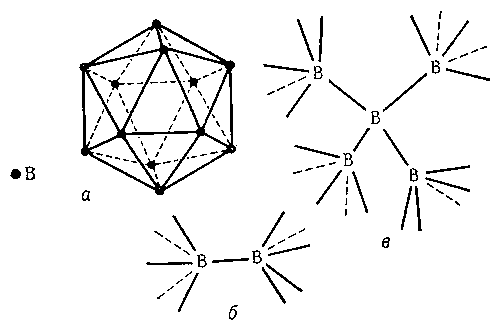
Физические и химические свойства. Известно несколько кристаллических модификаций Б. Для двух из них рентгеноструктурным анализом удалось полностью определить кристаллическую структуру, которая в обоих случаях оказалась весьма сложной. Атомы Б. образуют в этих структурах трёхмерный каркас подобно атомам углерода в алмазе. Этим объясняется высокая твёрдость Б. Однако строение каркаса в структурах Б. гораздо сложнее, чем в алмазе. Основной структурной единицей в кристаллах Б. служат двадцатигранники (икосаэдры), в вершинах каждого из которых находятся 12 атомов Б. (рис., а). Икосаэдры соединяются между собой как непосредственно (рис., б), так и посредством промежуточных атомов Б., не входящих в состав какого-либо икосаэдра (рис., в). При таком строении оказывается, что атомы Б. в кристаллах имеют разные координационные числа: 4, 5, 6 и 5 + 2 (5 ближних "соседей" и 2 более далёких). Т. к. на внешней оболочке атома Б. находятся всего 3 электрона (электронная конфигурация 2s22p), на каждую присутствующую в кристаллическом Б. связь приходится существенно меньше двух электронов. В соответствии с современными представлениями, в кристаллах Б. осуществляется особый тип ковалентной связи - многоцентровая связь с дефицитом электронов. В соединениях ионного типа Б. 3-валентен. Так называемый "аморфный" Б., получаемый при восстановлении B2O3 металлическим натрием или калием, имеет плотность 1,73 г/см3. Чистый кристаллический Б. имеет плотность 2,3 г/см3, температуру плавления 2075 °С, температуру кипения 3860 °С; твёрдость Б. по минералогической шкале 9, микротвёрдость 34 Гн/м2 (3400 кгс/мм2). Кристаллический Б. - полупроводник. В обычных условиях он проводит электрический ток плохо. При нагревании до 800°С электрическая проводимость Б. увеличивается на несколько порядков, причём знак проводимости меняется (электронная - при низких температурах, дырочная - при высоких) (см. Полупроводниковые материалы).
Химически Б. при обычных условиях довольно инертен (взаимодействует активно лишь с фтором), причём кристаллический Б. менее активен, чем аморфный. С повышением температуры активность Б. возрастает и он соединяется с кислородом, серой, галогенами. При нагревании на воздухе до 700 °С Б. горит красноватым пламенем, образуя борный ангидрид B2O3 - бесцветную стекловидную массу. При нагревании выше 900 °С Б. с азотом образует Бора нитрид BN, при нагревании с углём - Бора карбид B4C, с металлами - Бориды. С водородом Б. заметно не реагирует; его гидриды (Бороводороды) получают косвенным путём. При температуре красного каления Б. взаимодействует с водяным паром: 2B + 3Н2О = B2O3 + 3H2. В кислотах Б. при обычной температуре не растворяется, кроме концентрированной азотной кислоты, которая окисляет его до борной кислоты (См. Борная кислота) H3BO3. Медленно растворяется в концентрированных растворах щелочей с образованием боратов.
Во фториде BF3 и других галогенидах Б. связан с галогенами тремя ковалентными связями. Поскольку для завершения устойчивой 8-электронной оболочки атому Б. в галогениде BX3 недостаёт пары электронов, молекулы галогенидов, особенно BFз, присоединяют молекулы других веществ, имеющие свободные электронные пары, например аммиака
В таких комплексных соединениях (См. Комплексные соединения) атом Б. окружен четырьмя атомами (или группами атомов), что соответствует характерному для Б. в его соединениях координационному числу 4. Важные комплексные соединения Б. - Борогидриды, например Na [BH4], и фтороборная, или борофтористоводородная, кислота H [BF4], образующаяся из BF3 и HF; большинство солей этой кислоты (фтороборатов) растворимы в воде (за исключением солей К, Rb, Cs). Общая особенность самого Б. и его соединений - их сходство с кремнием и его соединениями. Так, борная кислота, подобно кремниевой, обладает слабыми кислотными свойствами и растворяется в HF с образованием газообразного BF3 (кремниевая даёт SiF4). Бороводороды напоминают кремневодороды, а карбид Б. - карбид кремния, и т.д. Представляет интерес особое сходство модификаций нитрида BN с графитом или алмазом. Это связано с тем, что атомы В и N по электронной конфигурации совместно имитируют 2 атома С (у В - 3 валентных электрона, у N - 5, у двух атомов С - по 4). Эта аналогия характерна и для других соединений, содержащих одновременно Б. и азот. Так, боразан BH3-NH3 подобен этану СН3-СН3, а боразен BH2=NH2 и простейший боразин BH≡NH подобны соответственно этилену СН2=СН2 и ацетилену CH≡CH. Если тримеризация ацетилена C2H2 даёт бензол C6H6, то аналогичный процесс приводит от боразина BHNH к Боразолу B3N3H6 (см. также Борорганические соединения).
Получение и применение. Элементарный Б. из природного сырья получают в несколько стадий. Разложением боратов горячей водой или серной кислотой (в зависимости от их растворимости) получают борную кислоту, а её обезвоживанием - борный ангидрид. Восстановление В2О3 металлическим магнием даёт Б. в виде темно-бурого порошка; от примесей его очищают обработкой азотной и плавиковой кислотами. Очень чистый Б., необходимый в производстве полупроводников, получают из его галогенидов: восстанавливают BCl3 водородом при 1200°С или разлагают пары BBr3 на танталовой проволоке, раскалённой до 1500°С. Чистый Б. получают также термическим разложением бороводородов.
Б. в небольших количествах (доли \%) вводят в сталь и некоторые сплавы для улучшения их механических свойств; уже присадка к стали 0,001-0,003\% Б. повышает её прочность (обычно в сталь вводят Б. в виде Ферробора, т. е. сплава железа с 10-20\% Б.). Поверхностное насыщение стальных деталей бором (до глубины 0,1-0,5 мм) улучшает не только механические свойства, но и стойкость стали против коррозии (см. Борирование). Благодаря способности изотопа 10В поглощать тепловые нейтроны, его применяют для изготовления регулирующих стержней ядерных реакторов (См. Ядерный реактор), служащих для прекращения или замедления реакции деления. Б. в виде газообразного BF3 используют в счётчиках нейтронов. (При взаимодействии ядер 10В с нейтронами образуются заряженные α-частицы, которые легко регистрировать; число же α-частиц равно числу нейтронов, поступивших в счётчик: 105B + 10n = 73Li + 42α) (см. также Нейтронные детекторы и индикаторы). Сам Б. и его соединения - нитрид BN, карбид B4C, фосфид ВР и др. - применяют как диэлектрики и полупроводниковые материалы. Обширное применение находят борная кислота и её соли (прежде всего бура), бориды и др. BF3 - катализатор некоторых органических реакций.
Лит.: Некрасов Б. В., Основы общей химии, т. 2, М., 1967; Щукарев С. А., Лекции по курсу общей химии, т. 2, Л., 1964; Бор, его соединения и сплавы, К., 1960.
В. Л. Василевский.
Б. в организме. Б. относится к числу химических элементов, которые в очень малых количествах содержатся в тканях растений и животных (тысячные и десятитысячные доли \% на сухую массу). Б. необходим для поддержания нормальной жизнедеятельности растений. Важнейший симптом недостатка Б. - отмирание точки роста главного стебля, а затем и пазушных почек. Одновременно черешки и листья становятся хрупкими, цветки не появляются или не образуются плоды; поэтому при недостатке Б. падает урожай семян. Известны многие болезни, связанные с недостатком Б., например гниль сердечка сахарной свёклы, чёрная пятнистость столовой свёклы, побурение сердцевины брюквы и цветной капусты, засыхание верхушки льна, желтуха верхушки люцерны, бурая пятнистость абрикосов, опробковение яблок. При недостатке Б. замедляется окисление сахаров, аминирование продуктов углеводного обмена, синтез клеточных белков; однако ферменты, для которых Б. является необходимым элементом, пока неизвестны. По данным М. Я. Школьника, при недостатке Б. у растений снижается содержание аденозинтрифосфорной кислоты, а также нарушается процесс окислительного фосфорилирования (См. Окислительное фосфорилирование), вследствие чего энергия, выделяющаяся при дыхании, не может быть использована для синтеза необходимых веществ. При недостатке Б. в почве в неё вносят борные удобрения (см. Микроудобрения). В биогеохимических провинциях с избытком Б. в почве (например, в Северо-Западном Казахстане) возникают морфологические изменения и заболевания растений, вызываемые накоплением Б., - гигантизм, карликовость, нарушение точек роста и др. На почвах с интенсивным борным засолением встречаются участки, лишённые растительности, "плешины", - один из поисковых признаков месторождения Б. Значение Б. в организме животных пока не выяснено. У человека и животных (овец, верблюдов) при питании растениями с избыточным содержанием Б. (60-600 мг/кг сухого вещества и более) нарушается обмен веществ (в частности, активность протеолитических ферментов) и появляется эндемическое заболевание желудочно-кишечного тракта - борный энтерит.
Лит.: Скок Дж., функция бора в растительной клетке, в кн.: Микроэлементы, пер. с англ., М., 1962; Ковальский В. В., Ананичев А. В., Шахова И. К., Борная биогеохимическая провинция Северо-Западного Казахстана, "Агрохимия", 1965, № 11.
В. В. Ковальский.
Рисунок к ст. Бор (химич. элемент).
V
сосновый лес, произрастающий преимущественно на сухой песчаной почве (сосновые леса, произрастающие на избыточно влажных и сырых почвах, на сфагновых болотах, Б. не называют). В СССР Б. занимают огромные площади от тундры до южной границы ареала сосны (См. Сосна). Типичные Б. растут на дюнных холмистых местах и плато. В них нет подлеска; в живом напочвенном покрове преобладают лишайники. Эти леса составляют группу сухих Б. - беломошников или лишайниковых и близких к ним типов леса. На пологих склонах со свежими песчаными почвами произрастают свежие Б. - брусничники, черничники, чистые зеленомошники. В их составе могут встретиться берёза, местами ель и другие породы; в подлеске - единично рябина, можжевельник и др.; в живом покрове - брусника, черника, зелёные мхи. На более богатых супесчаных и суглинистых почвах развиваются сложные Б. двух-, трёхпородного состава (сосна с елью, сосна с дубом, сосна с липой и лещиной) с развитым подлеском и хорошо выраженным покровом. Такие Б. дают много ценной деловой древесины. См. также Сосновые леса.
А. П. Шиманюк.

Равнинный бор Прииртышья.
VI
(Milium)
род растений семейства злаков. Многолетние, реже однолетние травы с мелкими одноцветковыми колосками, собранными в раскидистые метёлки. 6 видов, распространённых в умеренном поясе Северного полушария. В СССР - 3 вида. Б. развесистый (Milium effusum) - многолетний корневищный злак с широколинейными листьями, растущий в лесах, зарослях кустарников. Это растение охотно поедается скотом, но большого кормового значения оно не имеет, т.к. растет большей частью в незначительных количествах.
Лит.: Кормовые растения сенокосов и пастбищ СССР, под ред. И. В. Ларина, т. 1, М. - Л., 1950.
VII
город в Горьковской области РСФСР. Расположен на левом берегу Волги, против г. Горького, с которым соединён автодорожным мостом (с 1965). Ж.-д. ст. (Моховые Горы). 51 тыс. жителей (1969). Судоремонт, производство судового и портового оборудования, стекольный (оконное стекло, стеклопрофилит, стекла для автомобильной промышленности и др.), силикатный, металлопрокатный, ремонтно-механический, авторемонтный, торгового оборудования и торгового машиностроения заводы, мебельная, войлочная, сапоговаляльная, первичной обработки шерсти, строчевышивальная фабрики. Значительная часть предприятий Б. связана с заводами г. Горького. Вечерний индустриальный техникум, культурно-просветительное училище. Дом отдыха. Первые сведения о Б. относятся к 14 в., город с 1938.
Лит.: Трубе Л. Л., Наши города. Горький, 1954.
VIII
город в Югославии, в восточной Сербии, в Восточно-Сербских горах. 20 тыс. жителей (1965). Центр меднорудной (крупнейший рудник в зарубежной Европе) и медеплавильной промышленности страны.
бор
1. м.
Хвойный, обычно сосновый лес, растущий на сухом возвышенном месте.
2. м.
Химический элемент, входящий в состав многих минералов, твердое кристаллическое вещество.
3. м.
Стержень различной формы с насечками, приводимый во вращение бормашиной в зубоврачебной практике.
Хвойный, обычно сосновый лес, растущий на сухом возвышенном месте.
2. м.
Химический элемент, входящий в состав многих минералов, твердое кристаллическое вещество.
3. м.
Стержень различной формы с насечками, приводимый во вращение бормашиной в зубоврачебной практике.
БОР
(др.-исл. рожденный), в скандинавской мифологии один из богов-прародителей, сын первочеловека Бури, отец Одина.
---
город (с 1938) в Российской Федерации, Нижегородская обл., на р. Волга. Соединен автомобильным мостом с г. Н. Новгород. Железнодорожная станция (Моховые Горы). 64,5 тыс. жителей (1992). Машиностроение (судовое, портовое, торговое оборудование), стекольная промышленность. Известен с 14 в.
---
город в республике Сербия. 35 тыс. жителей (1981). Медеплавильная промышленность. В районе Бора - один из крупнейших меднорудных районов страны. Разрабатывается с 1903. Вулканогенно-осадочные, медно-колчеданные месторождения. Главное месторождение - бор с разведанными запасами руд 90 млн. т. при среднем содержании Cu 1,5%. Общие запасы района 3 млн. т меди. Добыча подземным и открытым способами.
---
сосновый лес на песчаных и каменистых почвах; иногда с примесью березы, почти без подлеска.
---
(лат. Borum), В, химический элемент III группы периодической системы, атомный номер 5, атомная масса 10,811. Название от позднелат. borax - бура. Бесцветные, очень твердые кристаллы (из-за примесей серовато-черные); плотность 2,31 - 2,35 г/см3, tпл 2074 °С. При обычной температуре химически инертен. В природе встречается главным образом в виде боратов. Применяют как компонент коррозионностойких и жаропрочных сплавов, композиционных материалов (в т. ч. боропластиков), сплавов для регулирующих устройств ядерных реакторов, а также для борирования.
---
(Bohr) Нильс Хенрик Давид (1885-1962) , датский физик, один из создателей современной физики. Основатель (1920) и руководитель Института теоретической физики в Копенгагене (Институт Нильса Бора); создатель мировой научной школы; иностранный член АН СССР (1929). В 1943-45 работал в США. Создал теорию атома, в основу которой легли планетарная модель атома, квантовые представления и предложенные им Бора постулаты. Важные работы по теории металлов, теории атомного ядра и ядерных реакций. Труды по философии естествознания. Активный участник борьбы против атомной угрозы. Нобелевская премия (1922).
---
Оге (р. 1922), датский физик. Сын Н. Бора. Один из авторов обобщенной модели атомного ядра. Нобелевская премия (1975, совместно с Б. Моттельсоном и Дж. Рейнуотером).
---
Харальд (1887-1951) , датский математик. Брат Н. Бора. Труды по теории почти периодических функций.
---
город (с 1938) в Российской Федерации, Нижегородская обл., на р. Волга. Соединен автомобильным мостом с г. Н. Новгород. Железнодорожная станция (Моховые Горы). 64,5 тыс. жителей (1992). Машиностроение (судовое, портовое, торговое оборудование), стекольная промышленность. Известен с 14 в.
---
город в республике Сербия. 35 тыс. жителей (1981). Медеплавильная промышленность. В районе Бора - один из крупнейших меднорудных районов страны. Разрабатывается с 1903. Вулканогенно-осадочные, медно-колчеданные месторождения. Главное месторождение - бор с разведанными запасами руд 90 млн. т. при среднем содержании Cu 1,5%. Общие запасы района 3 млн. т меди. Добыча подземным и открытым способами.
---
сосновый лес на песчаных и каменистых почвах; иногда с примесью березы, почти без подлеска.
---
(лат. Borum), В, химический элемент III группы периодической системы, атомный номер 5, атомная масса 10,811. Название от позднелат. borax - бура. Бесцветные, очень твердые кристаллы (из-за примесей серовато-черные); плотность 2,31 - 2,35 г/см3, tпл 2074 °С. При обычной температуре химически инертен. В природе встречается главным образом в виде боратов. Применяют как компонент коррозионностойких и жаропрочных сплавов, композиционных материалов (в т. ч. боропластиков), сплавов для регулирующих устройств ядерных реакторов, а также для борирования.
---
(Bohr) Нильс Хенрик Давид (1885-1962) , датский физик, один из создателей современной физики. Основатель (1920) и руководитель Института теоретической физики в Копенгагене (Институт Нильса Бора); создатель мировой научной школы; иностранный член АН СССР (1929). В 1943-45 работал в США. Создал теорию атома, в основу которой легли планетарная модель атома, квантовые представления и предложенные им Бора постулаты. Важные работы по теории металлов, теории атомного ядра и ядерных реакций. Труды по философии естествознания. Активный участник борьбы против атомной угрозы. Нобелевская премия (1922).
---
Оге (р. 1922), датский физик. Сын Н. Бора. Один из авторов обобщенной модели атомного ядра. Нобелевская премия (1975, совместно с Б. Моттельсоном и Дж. Рейнуотером).
---
Харальд (1887-1951) , датский математик. Брат Н. Бора. Труды по теории почти периодических функций.
Бор
БОР
I
сосновый лес.
II
стальное сверло в бормашине.
Википедия
Бор
Бор может означать:
- Бор — сосновый лес.
- Бор — химический элемент.
- Бор — один из скандинавских богов-прародителей, отец Одина.
- Бор (лат. Milium) — род растений семейства Злаки.
- Бор — аномально высокая приливная волна в устьях рек.
- Бор — кратер на видимой стороне Луны.
- Бор, или Префиксное дерево — структура данных.
- Бор — снайперская винтовка польского производства.
- Бор — сверло, применяемое в стоматологии, деталь бормашины.
- Бор — одномачтовое однопалубное буксирное судно.
- «Бор» — сербский футбольный клуб из города Бора.

